RESEARCH
全身を張り巡らす血管は、からだのすべての細胞に酸素や栄養を供給し、二酸化炭素や老廃物を回収するいわば“生命維持に必須のライフライン”です。しかし、最近の研究から、血管は単に血液を運搬する管ではなく、より多様な機能を有することが明らかになりつつあります。例えば、血管内皮細胞は、臓器ごとに特有の機能遺伝子を発現し、各臓器の機能を担っています。また、血管内皮細胞はアンジオクラインファクターと呼ばれる生理活性物質を産生することで、臓器の形成や維持、組織修復、幹細胞の維持など多様な機能を制御することが分かってきました。このため血管機能の異常は、日本人の主要な死因を含む様々な疾患の発症や進展と密接に関連しています。また、人は加齢とともに老化しますが、その根本的な原因のひとつも血管機能の破綻にあると考えられています。したがって、人が健康で長生きできる社会の実現には、血管に関する理解を深めることがとても重要です。
私たちの研究室では、“血管が如何に形作られ機能しているのか?”、“血管機能の破綻が如何に様々な病気の発症や進展、加齢に伴う個体老化を引き起こすのか?”といった疑問を分子・細胞・臓器・個体レベルで解明することを目的に研究を進めています。
- ゼブラフィッシュを用いた蛍光イメージングによる血管研究
- 血管新生の多様性と普遍性の解明
- ペリサイトが血管機能を制御する機序とその維持機構
- 血管透過性を制御するシグナル伝達機構と疾患・加齢による変容機構
- 加齢による血管の臓器多様性喪失による個体老化機構(AMED CREST 「老化」領域プロジェクト)
高野グループ研究プロジェクト
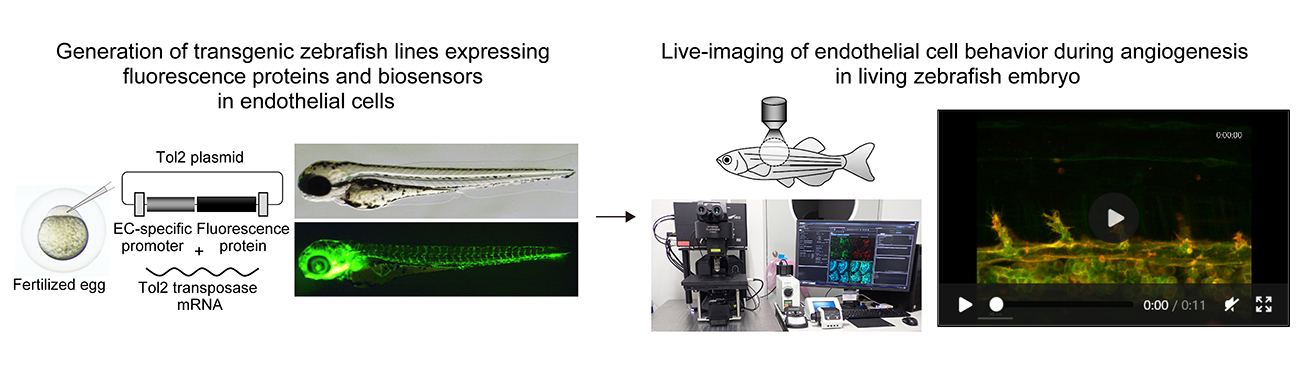
- 1. ゼブラフィッシュをモデル動物として用いた蛍光イメージングによる血管研究
- 「百聞は一見にしかず」のことわざが示す通り、生体内で起こる生命現象を直接“目で見る”ことができれば、これらの現象を司る仕組みを明らかにできます。私たちは、小型魚類であるゼブラフィッシュをモデル動物とし、蛍光イメージング技術を駆使して、生きた個体の細胞をリアルタイムで解析する“in vivo細胞生物学研究”を展開しています。具体的には、血管内皮細胞や壁細胞(ペリサイトや血管平滑筋細胞)でGFPなどの蛍光タンパク質や分子や細胞の機能情報を可視化する蛍光バイオセンサーを発現するゼブラフィッシュを樹立し、生きたまま顕微鏡下で観察することで、血管新生の制御メカニズムやペリサイトの血管機能における役割を研究しています。詳細な内容については、2、3をご参照ください。
- 石井智裕ら. DOJIN BIOSCIENCE SERIES「血管・リンパ管の機能制御と疾患メカニズム」(化学同人)第12章 ゼブラフィッシュをモデル動物として用いた血管新生の蛍光イメージング, 107-120, 2022.
- Fukuhara S. et al. Looking back and moving forward: Recent advances in understanding of cardiovascular development by imaging of zebrafish. Dev. Growth Differ. 57: 333-40, 2015.
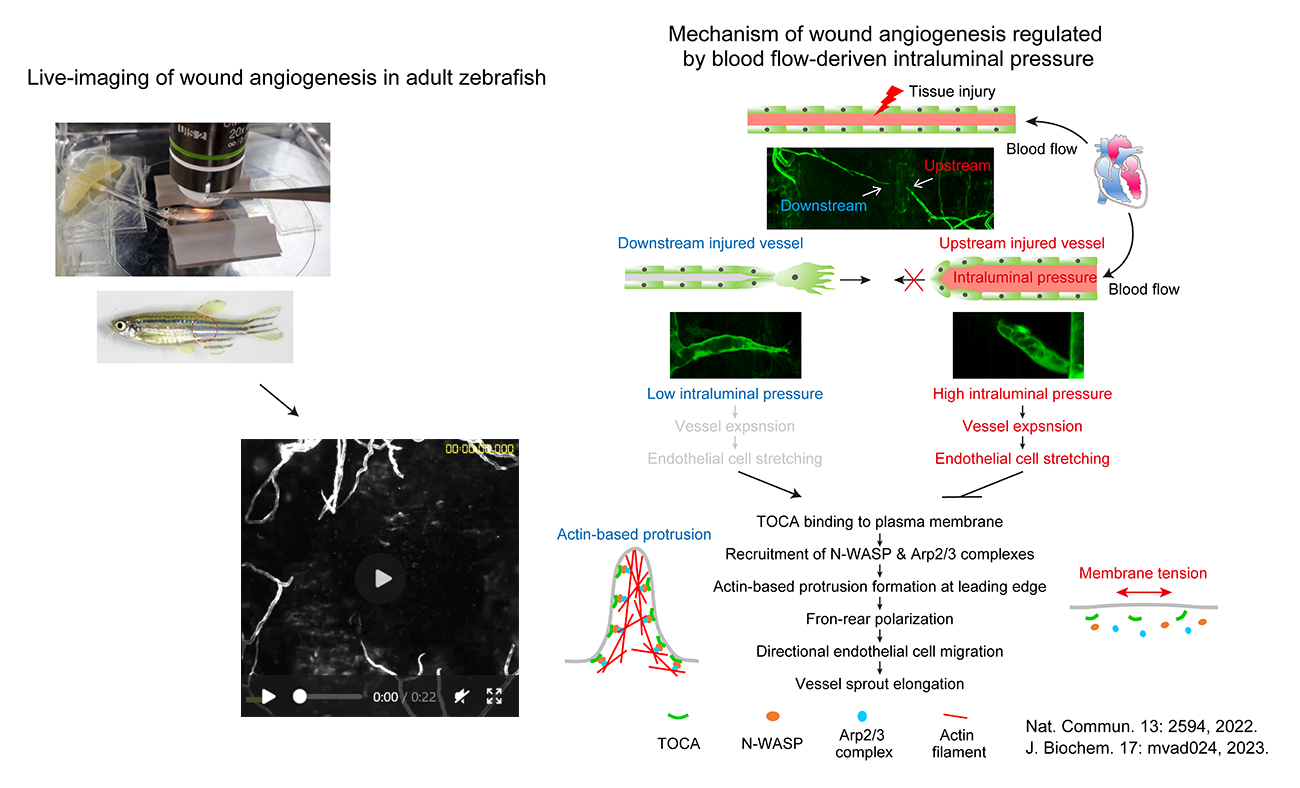
- 2. 血管新生の多様性と普遍性
- 血管新生とは、既存の血管から血管の枝が発生し伸長し、新しい血管網が形成される現象です。体内を張り巡る多くの血管も、発生期において血管新生により形成されます。成体では、創傷などにより組織が虚血状態になると、これに対処するために生理的な血管新生が誘導され、組織修復に寄与します。このように、血管新生は生体の恒常性を維持する上で重要ですが、様々な病気とも密接に関連しています。例えば、がんや加齢黄斑変性症などの疾患では、病的な血管新生により未熟で異常な血管が形成され、それにより病態が悪化することが知られています。しかし、生体にとって有用な生理的血管新生と病気を悪化させる病的血管新生がどのようなメカニズムで制御されているかは不明です。
私たちは、これまでゼブラフィッシュの蛍光イメージング解析を通じて、発生期における血管新生の制御機構を研究し、その一端を明らかにしてきました。さらに、成魚を長時間ライブイメージングできるシステムを独自に開発し、創傷治癒(損傷を受けた組織が修復するプロセス)における血管新生の制御機構を解析してきました。それにより、血流に由来する血管内腔の内腔圧が、創傷治癒における血管新生を厳密に制御していることを発見しました。現在、発生期や創傷治癒における血管新生の制御機構の解析を進めつつ、なぜ、がんなどの疾患では病的な血管新生が誘導され、異常な血管が形成されるのかについても研究を進めています。
- Yuge S. et al. Novel regulatory mechanisms underlying angiogenesis during wound healing revealed by fluorescence-based live-imaging in zebrafish. J. Biochem. 17: mvad024, 2023. Review
- Yuge S.*, Nishiyama K.* et al. Mechanical loading of intraluminal pressure mediates wound angiogenesis by regulating the TOCA family of F-BAR proteins. Nat. Commun. 13: 2594, 2022.
- Nishimura Y.*, Ishii T.* et al. Blood flow regulates glomerular capillary formation in zebrafish pronephros. Kidney360 3: 700-713, 2022.
- Noishiki C.*, Yuge S.* et al. Live imaging of angiogenesis during cutaneous wound healing in adult zebrafish.
Angiogenesis 22: 341-354, 2019. - Wakayama Y. et al. Cdc42 mediates Bmp-induced sprouting angiogenesis through Fmnl3-driven assembly of endothelial filopodia in zebrafish. Dev. Cell 32: 109-22, 2015.
- Kashiwada T. et al. β-Catenin-dependent transcription is central to Bmp-mediated formation of venous vessels.
Development 142: 497-509, 2015. - Fukuhara S. et al. Visualizing the cell-cycle progression of endothelial cells in zebrafish. Dev. Biol. 393: 10-23, 2014.
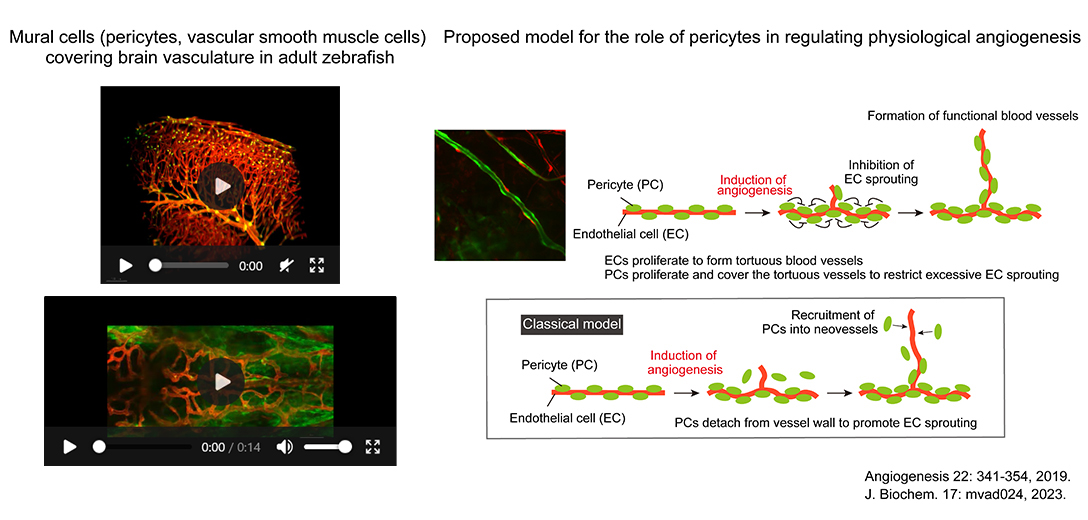
- 3. ペリサイトが血管機能を制御する機序とその維持機構
- 細胞に酸素や栄養を受け渡す毛細血管などの細い血管では、ペリサイトが血管内皮細胞を被覆しています。ペリサイトは、血管壁を被覆することにより、血管の安定性や血管透過性、血流を制御すると考えられていますが、その詳細は明らかにされていません。私たちは、ゼブラフィッシュの蛍光イメージング解析を通じて、ペリサイトの機能とその制御機構について研究を進めています。また、内皮細胞の寿命は数年であることが知られていますが、一方でペリサイトの寿命やその維持機構についてはほとんど研究が進んでいません。私たちは、この疑問についても研究を進め、そのメカニズムの一端を明らかにしつつあります。
さらに、血管新生におけるペリサイトの機能についても研究を進めています。これまで、血管新生が誘導されると、ペリサイトは血管壁から離れて内皮細胞の出芽を促進すると考えられてきました。しかし、成魚の創傷治癒過程の血管新生のライブイメージング解析から、血管新生誘導時にペリサイトは血管壁から離れず、逆に内皮細胞とともに増殖して、活性化した内皮細胞を被覆することを発見しました。現在、ペリサイトを選択的に除去できるゼブラフィッシュを樹立し、血管新生におけるペリサイトの真の機能とその制御機構について研究を進めています。
- Yuge S. et al. Novel regulatory mechanisms underlying angiogenesis during wound healing revealed by fluorescence-based live-imaging in zebrafish. J. Biochem. 17: mvad024, 2023. Review
- Noishiki C.*, Yuge S.* et al. Live imaging of angiogenesis during cutaneous wound healing in adult zebrafish.
Angiogenesis 22: 341-354, 2019. - Ando K. et al. Clarification of mural cell coverage of vascular endothelial cells by live imaging of zebrafish.
Development 143: 1328-39, 2016.
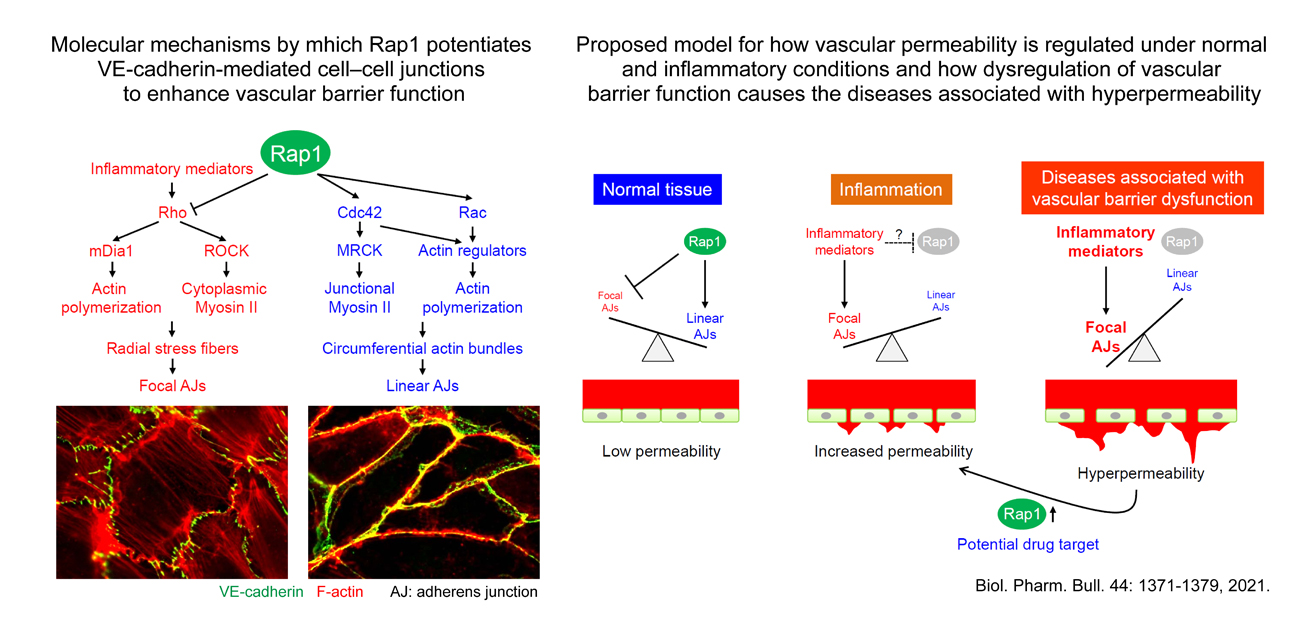
- 4. 血管透過性を制御するシグナル伝達機構と疾患・加齢による変容機構
- 血管の内腔面では、血管内皮細胞が互いに接着することで血液の漏出を防ぐバリアを形成しています。正常な抹消組織の血管では、内皮特異的な接着分子Vascular endothelial (VE)-cadherinが、細胞間接着を形成し、血管透過性を低い状態に維持しています。しかし、炎症が誘導されると生体防御機構として、VE-cadherin接着が減弱し、血管透過性が亢進することで、免疫細胞の血管外への移動や血漿成分の漏出が誘導されます。このように、血管には血管バリア機能をダイナミックかつ厳密に制御するための仕組みが備わっていますが、その破綻はさまざまな疾患の病態を悪化させます。
私たちはこれまでに、Rasファミリーに属する低分子量Gタンパク質の一つであるRap1が、VE-cadherin接着を促進し、血管バリア機能を強化する役割を発見しました。Rap1は、RhoとCdc42の活性を巧みに調節し、アクチン細胞骨格を劇的に再編することでVE-cadherin接着を増強し、血管透過性を低下させることを示しました。また、最近、内皮特異的Rap1欠損マウスが重度の肺水腫により死亡することを発見し、Rap1は肺胞毛細血管のバリア機能維持に必須のシグナル分子であること明らかにしました。
肺胞では、毛細血管内皮細胞が血管バリアを構築し、肺胞腔への血液漏れを防いでいます。しかし、新型コロナウイルス感染症などの感染症や重症肺炎では、VE-cadherin接着が崩壊し、急性呼吸窮迫症候群(ARDS)として知られる非心原性肺水腫が発生します。ARDSで重症化する患者さんの中には高齢者が多いことが報告されていますが、その原因は未だ解明されていません。私たちはRap1シグナルに焦点を当て、「なぜ高齢者では肺胞毛細血管のバリア機能が破綻しやすく、重症化のリスクが高まるのか?」という疑問の解明を目指し研究を進めています。
- Watanabe-Takano H. et al. Endothelial cells regulate alveolar morphogenesis by constructing basement membranes acting as a scaffold for myofibroblasts.Nat. Commun.15: 1622, 2024.
- Yamamoto K. et al. Rap1 small GTPase is essential for maintaining pulmonary endothelial barrier function in mice.
FASEB J. 12: e23310, 2023. - Yamamoto K. et al. Rap1 small GTPase regulates vascular endothelial-cadherin-mediated endothelial cell-cell junctions and vascular permeability.
Biol. Pharm. Bull. 44: 1371-1379, 2021. Review - Rho S. et al. Rap1b promotes Notch signal-mediated hematopoietic stem cell development by enhancing integrin-mediated cell adhesion. Dev. Cell 49: 681-696.e6, 2019.
- Rho S. et al. Dynamic regulation of vascular permeability by vascular endothelial cadherin-mediated endothelial cell-cell junctions.
J. Nippon Med. Sch. 84:148-159, 2017. Review - Ando K. et al. Rap1 potentiates endothelial cell junctions by spatially controlling myosin II activity and actin organization.
J. Cell Biol. 202: 901-916, 2013. - Fukuhara S. et al. The sphingosine-1-phosphate transporter Spns2 expressed on endothelial cells regulates lymphocyte trafficking in mice.
J. Clin. Invest. 122: 1416-1426, 2012. - Noda K. et al. Vascular endothelial-cadherin stabilizes at cell-cell junctions by anchoring to circumferential actin bundles through α- and β-catenins in cyclic AMP-Epac-Rap1 signal-activated endothelial cells.Mol. Biol. Cell 21: 584-596, 2010.
- Fukuhara S. et al. Cyclic AMP potentiates VE-cadherin–mediated cell-cell contact to enhance endothelial barrier function through an Epac-Rap1 signaling pathway. Mol. Cell. Biol. 25: 136-146, 2005.
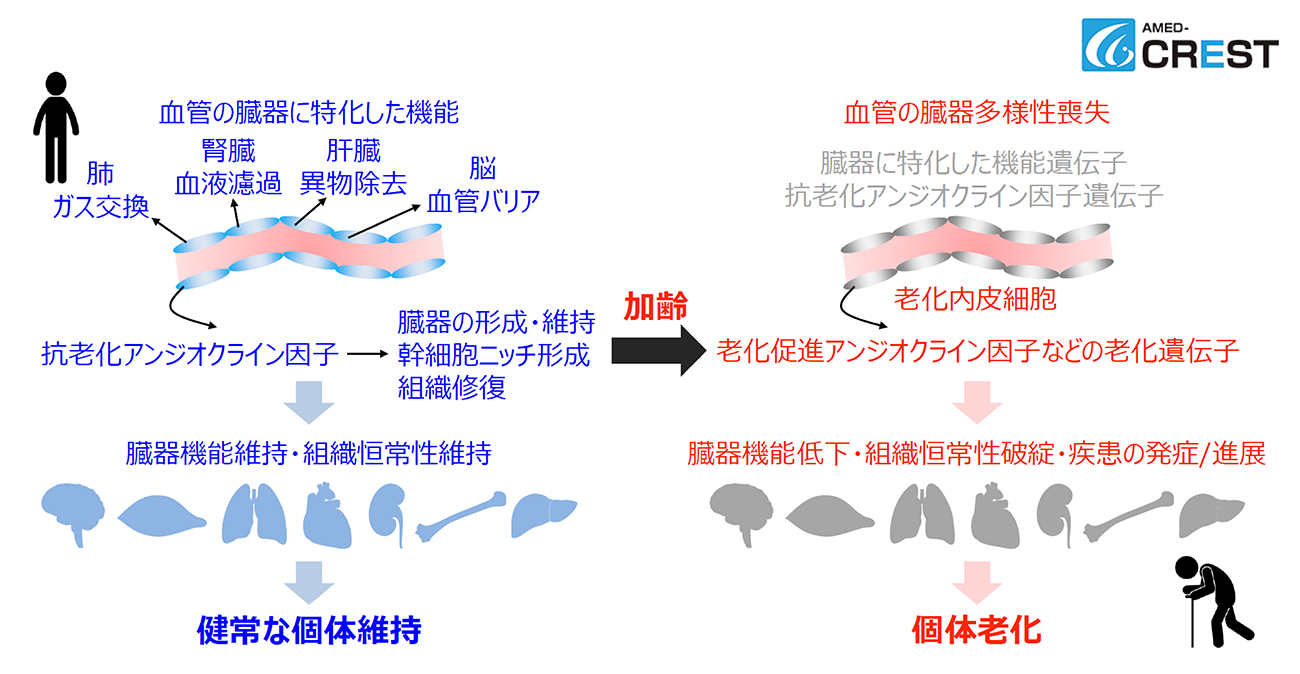
- 5. 加齢による血管の臓器多様性喪失による個体老化機構(AMED CREST 「老化」 プロジェクト)
- 血管は単に血液を運搬する管ではなく、臓器ごとに特有の機能を有し、わたしたちの体を維持しています。また、血管内皮細胞は、アンジオクライン因子と呼ばれる生理活性物質を産生し、臓器の形成・維持、組織修復など多様な機能を制御する一方で、がんや線維症などの疾患の病態にも関与しています。しかし、血管内皮細胞が担う臓器特有の機能が、加齢により如何に変容し、個体老化にどのような影響を与えるのか、また、アンジオクライン因子が個体老化をどのように制御しているのかは、未だ明らかにされていません。私たちは、最近、加齢により、各臓器の血管内皮細胞において、臓器に特化した機能遺伝子・アンジオクライン因子遺伝子の発現が低下し、逆に老化促進アンジオクライン因子などの老化遺伝子の発現が亢進することを発見しました。この知見は、加齢とともに、血管内皮細胞は臓器特有の多様な機能を喪失し、その一方で、老化遺伝子を発現することで、臓器や個体の老化を積極的に促進している可能性を示しています。
そこで本研究プロジェクトでは、加齢により、血管内皮細胞が担う臓器特有の機能が破綻するメカニズムを明らかにし、加齢に伴う血管の臓器多様性喪失による個体老化機構の解明を目指しています。本研究目標を達成するため、血管内皮細胞のシングルセルRNAシークエンス解析やエピゲノム解析を行っています。また、血管内皮特異的老化モデルマウスや老化内皮細胞を可視化・系譜解析可能なマウスを樹立し、解析を進めています。
高野グループ研究プロジェクト